
Halo Quipperian! Pada kali ini Quipper Blog akan membahas suatu tema yang sangat menarik, lhoyaitu tentang titrasi asam-basa. Tahukah kamu kalau soal tentang larutan/titrasi asam-basa adalah soal yang selalu keluar dalam topik SBMPTN Kimia belakangan ini. Coba cek di sini deh soal SBMPTN Kimia yang sering keluar.
Namun ternyata masih banyak siswa yang kesulitan dalam menjawab soal ini dengan baik dikarenakan tidak memahami konsepnya secara mendalam, serta lupa meletakkan rumus umum dari titrasi asam-basa itu sendiri. Oleh sebab itu, pada kesempatan kali ini Quipper Blog akan membahas tentang definisi dari titrasi asam-basa, rumus umum titrasi asam-basa, istilah-istilah yang dipakai dalam titrasi asam-basa, jenis-jenis dari titrasi, metode atau prosedur titrasi, serta soal dan pembahasan tentang titrasi asam-basa dari bank soal Quipper Video. Penasaran? Let’s check this out!
Pengertian Titrasi Asam-Basa

Titrasi asam-basa adalah prosedur yang dilakukan untuk menentukan kemolaran/kadar asam/basa berdasarkan reaksi netralisasi. Alat yang digunakan untuk melakukan titrasi disebut titrasimeter.Sebagaimana kita ketahui bahwa kemolaran menyatakan jumlah mol zat terlarut dari tiap liter larutan dan juga dapat digunakan untuk menentukan pengenceran dari suatu larutan. Rumus umumnya adalah sebagai berikut:
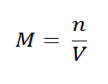
Di mana
M = kemolaran/molaritas (mol/L)
n = jumlah mol zat terlarut (mol)
V = Volume larutan/ruangan gas (L)
Rumus pengenceran larutan adalah sebagai berikut:

Percobaan Titrasi Asam-Basa
Percobaan dilakukan menggunakan sebuah indikator asam-basadan zat pentiter. Zat pentiter adalah zat yang mentitrasi suatu asam-basa yang akan ditentukan kemolarannya. Zat pentiter dibagi menjadi dua jenis yaitu :
- Primer : ketelitian tinggi. Contoh : KHF (Kalium Hidrogen Falat)
- Sekunder : kemolarannya ditentukan dengan larutan standar primer
Istilah dalam Percobaan Titrasi
Dalam melakukan percobaan titrasi, terdapat istilah-istilah penting yang perlu kita ketahui yaitu daerah perubahan pH drastis,titik ekuivalen,titik akhir titrasidan kurva titrasi.
- Daerah perubahan pH drastis adalah daerah dimana penambahan sedikit tetes pentiter dapat mengubah warna indikator asam-basa.
- Titik ekuivalen adalah titik di mana asam dan basa tepat habis bereaksi.
- Titik akhir titrasi adalah titik di mana indikator asam-basa mengalami perubahan warna.
- Kurva titrasi adalah grafik yang menyatakna perubahan pH pada penetesan asam dengan basa (atau sebaliknya). Kurva titrasi akan memudahkan kita menentukan titik ekuivalen dan titik akhir titrasi.
Terdapat 4 jenis titrasi asam-basa yang dapat dilakukan dalam percobaan yaitu asam kuat dengan basa kuat, basa kuat dengan asam kuat, asam kuat dengan basa lemah, basa lemah dengan asam kuat. Berikut jenis-jenis titrasi beserta kurva titrasi yang ditunjukkan pada gambar di bawah ini.

Langkah Melakukan Percobaan Titrasi dengan Baik

Percobaan titrasi harus dilakukan dengan benar dan sistematis. Berikut langkah-langkah melakukan percobaan titrasi dengan baik dan benar :
- Larutan yang akan diteteskan dimasukkan ke dalam buret (pipa panjang berskala), inilah yang disebut peniter.
- Larutan yang akan dititrasi dimasukkan ke dalam Erlenmeyer dengan mengukur volumenya terlebih dahulu memakai pipet volume.
- Memberikan beberapa tetes indikator pada larutan yang dititrasi, pilih indikator dengan perubahan warna titik ekuivalen.
- Lakukan titrasi, yaitu larutan yang berada dalam buret diteteskan perlahan-lahan melalui keran ke dalam Erlenmeyer sambil digoyang agar merata. Penambahan peniter dihentikan ketika sudah terjadi perubahan warna yang tidak hilang ketika larutan digoyangkan, yang menandakan telah mencapai titik akhir.
- Mencatat volume yang dibutuhkan peniter dengan melihat volume yang berkurang pada buret setelah titrasi.
Sudah dijelaskan sebelumnya bahwa titrasi dilakukan untuk menghitung derajat asam/basa atau kemolaran suatu larutan. Sebagaimana kita ketahui bahwa untuk menentukan derajat asam/basa disebut dengan pH. Ada dua pH yaitu pH asam atau pH basa. Di mana:
pH = 1-6 (daerah asam. pH = 1 disebut asam kuat)
pH = 7 ( daerah netral)
pH= 8-14 ( daerah basa. pH = 14 disebut basa kuat).
Solusi SUPER untuk menentukan pH campuran dua larutan adalah sebagai berikut:
Jika konsentrasi H+ campuran dua larutan asam kuat yang memiliki pH yang berbeda adalah:
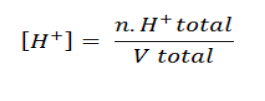
Konsentrasi OH– campuran dua larutan basa kuat yang memiliki pH yang berbeda adalah:

Yuk, Kerjakan Contoh Soalnya

Contoh Soal 1
Diketahui sampel Ba(OH)2sebanyak 25 mL tetap dititrasi oleh 100 mL HCl 0,1 M, tentukan konsentrasi sampel tersebut!
Penyelesaian:
Diketahui : V Ba(OH)2= 25 mL
V HCl = 100 mL
M HCl = 0,1 M
Elektron valensi HCl = 1
Elektron valensi Ba(OH)2= 2
Ditanyakan: Molaritas pada Ba(OH)2
Jawab:
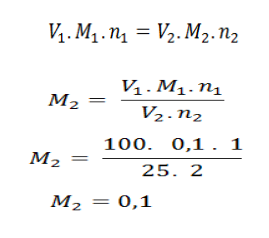
Jadi, nilai kemolaran pada larutan Ba(OH)2adalah 0,1 M.
Contoh soal 2
Sebuah larutan HCL dengan Volume 100 mL dan memiliki pH sebesar 4 ditetesi dengan larutan HCl yang memiliki pH=3. Tentukan nilai pH dari campuran kedua larutan tersebut.
Penyelesaian:
Diketahui:
Kedua larutan tersebut adalah HCl dimana HCl adalah asam kuat. Apabila asam kuat dengan asam kuat dicampurkan maka dapat ditentukan pH campurannya menggunakan persamaan:
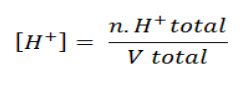
Cari dulu nilai molnya menggunakan persamaan:
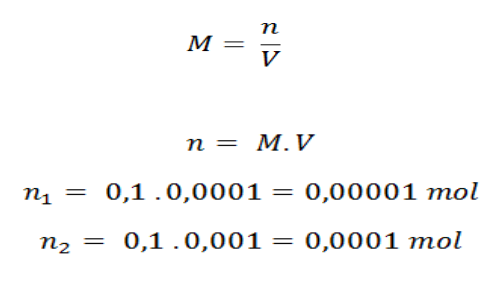
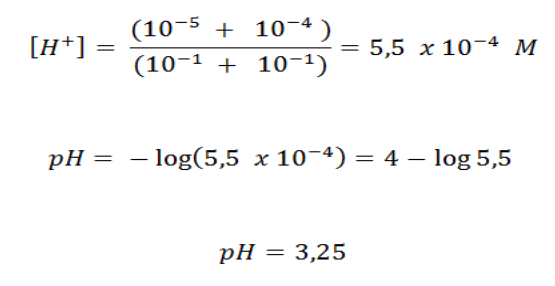
Jadi, pH campuran dari larutan asam kuat tersebut adalah 3,25
Contoh Soal 3

Penyelesaian:

Contoh Soal 4

Penyelesaian:

Bagaimana Quipperian sudah mulai memahami tentang konsep dan perhitungan dalam titrasi asam-basa? Ternyata enggak seseram yang dibayangkan ya, apabila kita menguasai konsep dasar beserta solusi SUPERnya dalam mengerjakan soal-soal tentang Kimia. Ayo gabung, bersama Quipper Video karena ada banyak video-video dan pembahasan soal dari tutor-tutor kece yang dapat membantu kamu memahami pelajaran lainnya serta memantapkan kamu untuk menghadapi segala ujian-ujian di sekolah kamu. Semangat!
Sumber:
- Priambodo, Erfan. Dkk. 2009. Aktif Belajar Kimia untuk SMA dan MA kelas XI. Jakarta: Kemdikbud
- Wardaya College.Titrasi Asam Basa. Jakarta: Wardaya College
- https://www.quipper.com/id/blog/sbmptn/kimia-sbmptn/sbmptn-saintek-pelajari-dulu-10-topik-teratas-yang-selalu-muncul-di-sbmptn-kimia/
- www.materi78files.wordpress.com
Sumber gambar:
Penulis: William Yohanes
