
Halo Quipperian! Pernahkah kalian melihat suatu besi yang mula-mula normal menjadi berkarat? Atau melihat seorang ilmuwan melakukan percobaan perubahan warna pada sebuah larutan yang dicampurkan? Kalau kalian mengamati dengan saksama, proses perkaratan pada sebuah besi membutuhkan waktu yang lama sedangkan perubahan warna pada larutan tersebut yang digabungkan membutuhkan waktu yang cepat.
Kedua contoh tersebut berkaitan dengan konsep kimia yaitu “laju reaksi”. Pengetahuan tentang kelajuan reaksi sangat berguna di dalam dunia industri, karena kegiatan industri menggunakan reaksi kimia untuk proses produksinya. Variabel waktu, tenaga, dan biaya di dalam industri sangat berarti lho, oleh sebab itu konsep tentang laju reaksi yang cepat dan terkendali akan sangat menguntungkan bagi para pelaku industri tersebut.
Makanya, pada sesi kali ini Quipper Blog akan membahas tentang pengertian tentang laju reaksi, persamaan laju reaksi, faktor-faktor yang mempengaruhi laju reaksi, teori tumbukan, dan contoh perhitungan laju reaksi pada reaksi kimia. Penasaran ? Check this out!
Pengertian Laju Reaksi

Laju reaksiadalah kecepatan proses terjadinya suatu reaksi, sehingga reaktan habis dan berubah menjadi produk reaksi. Laju reaksi ada yang cepat dan ada yang berlangsung lambat. Contoh laju reaksi berlangsung cepat adalah reaksi antara larutan asam dan basaatau reaksi pembakaran campuran bensin dan udara di dalam mesin kendaraan bermotor. Sedangkan contoh laju reaksi yang berlangsung lambat adalah perkaratan besi, reaksi-reaksi kimia dalam tubuh, dan reaksi antara bahan cat dan oksigen. Secara matematik, rumus umum laju reaksimerupakan perubahan jumlah molar zat per satuan waktu, ditulis sebagai berikut:

Di mana:
v = laju reaksi (M/s)
Δ[x] = perubahan konsentrasi molar zat (M)
Δt = perubahan waktu (s)
n = jumlah mol zat terlarut (mol)
V = volume larutan/ruangan gas (L)
Kelajuan reaksi makin lama akan semakin kecilnilainya apabila:
- Jumlah reaktan yang semakin berkurang dan pada akhirnya bernilai nol (reaksi selesai)
- Jumlah produk yang semakin bertambah dan pada akhirnya bernilai tetap (reaksi selesai)
Persamaan Laju Reaksi dan Laju Perubahan Konsentrasi

Persamaan laju reaksi juga dapat dikaitkan dengan laju perubahan konsentrasisuatu reaktan, sehingga dapat ditulis sebagai berikut:
Pada reaksi A + B → C + D
Nilai persamaan laju reaksiadalah sebagai berikut:
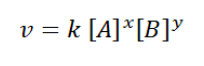
Di mana:
k = konstanta/tetapan laju reaksi
x = orde/tingkat reaksi terhadap A
y = orde/tingkat reaksi terhadap B
x = y = orde reaksi total
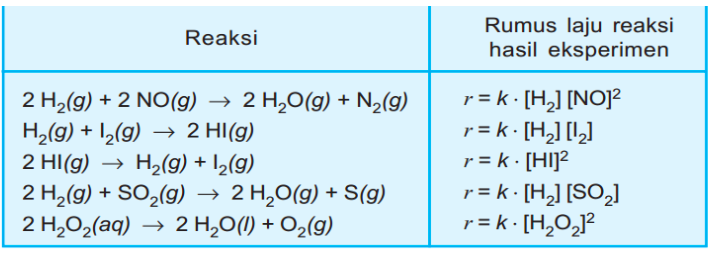
Contoh Reaksi dan Rumus Laju Reaksi dari Hasil Eksperimen
Berikut ini terdapat beberapa contoh reaksi dan rumus laju reaksi yang diperoleh dari hasil eksperimen:
Orde Reaksi & Konstanta Laju Reaksi

Orde Reaksi
Dari persamaan laju reaksi ada suatu istilah yaitu orde reaksidan konstanta laju reaksi. Orde reaksiadalah pangkat konsentrasi yang menunjukkan tingkat reaksi suatu zat. Orde reaksi ini tidak ditentukan dari koefisien reaksi, tapi dari data eksperimen. Nilai suatu orde reaksi dapat berupa bilangan positif, pecahan, nol,atau negatif.Secara matematis, nilai orde reaksi total adalah penjumlahan orde reaksi seluruh zat reaktan. Contoh:

Macam-macam orde reaksi total beserta grafik dijelaskan pada gambar di bawah ini:
a. Orde reaksi total nol
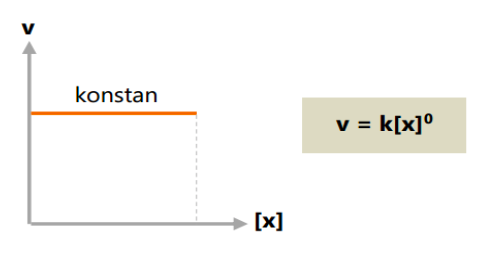
Pada orde reaksi nol, laju reaksi tidak dipengaruhi oleh konsentrasi zat (konstan).
b. Orde reaksi total satu
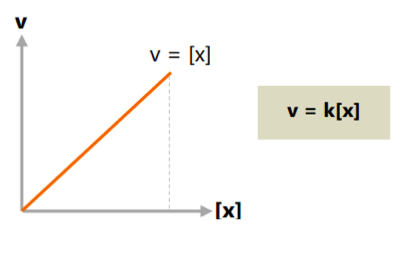
Pada orde reaksi satu, pertambahan laju reaksi sama dengan perubahan konsentrasi zat. Apabila konsentrasi reaktan reaksi orde satu dikali faktor n, maka nilai laju reaksinya adalah n lebih besar.
c. Orde reaksi total dua
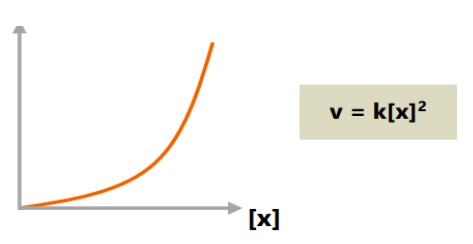
Apabila konsentrasi reaktan reaksi orde satu dikali faktor n, maka nilai laju reaksinya adalah n2lebih besar.
Konstanta Laju Reaksi
Konstanta laju reaksi (k)adalah tetapan yang harganya bergantung pada jenis pereaksi, suhu, dan katalis. Nilai konstanta laju reaksi berbanding terbalikdengan perubahan waktu. Semakin cepat reaksi berlangsung, maka nilai k semakin besar. Dan nilai konstanta laju reaksi berbanding lurus dengan perubahan suhu. Semakin tinggi suhu reaksi, maka nilai k semakin besar.
Kelajuan suatu reaksi dipengaruhi oleh beberapa faktor. Hal ini dapat dijelaskan menggunakan teoridan praktik/eksperimen.Secara eksperimen, faktor-faktor yang mempengaruhi laju reaksi, terdapat:
- Variabel bebas/manipulasi, yaitu variabel yang dapat diubah-ubah dalam eksperimen. Contoh: ukuran keping pualam (faktor luas permukaan), konsentrasi zat (faktor konsentrasi).
- Variabel terkontrolyaitu variabel yang dibuat tetap dalam seluruh eksperimen. Contoh: larutan yang diubah-ubah konsentrasinya, walaupun konsentrasinya berubah tetapi jenis larutannya tetap.
- Variabel terikat/responsyaitu variabel yang dihasilkan eksperimen. Contoh: dari seluruh eksperimen terhadap faktor-faktor yang mempengaruhi laju reaksi dihasilkan data berupa laju reaksi dan lama reaksi (waktu).
Teori Tumbukan

Teori yang membahas tentang kelajuan reaksi kimia adalah teori tumbukan.Bunyi teori tumbukan adalah “suatu reaksi berlangsung sebagai hasil tumbukan antar partikel pereaksi yang memiliki energi cukup dan arah tumbukan yang tepat”.
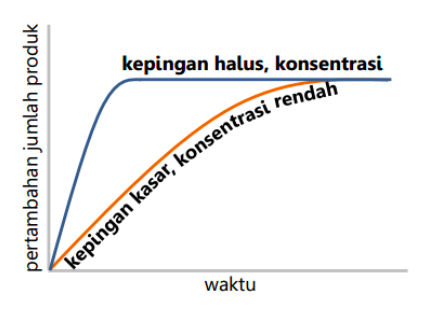
Faktor-faktor yang mempengaruhi tumbukan suatu partikel sehingga mempengaruhi juga terhadap kelajuan reaksi kimia yaitu luas permukaan, konsentrasi reaktan, suhu,dan katalis. Luas permukaanadalah luas bidang sentuh tempat terjadinya reaksi antara dua rekatan. Luas permukaan berbanding lurus dengan laju reaksi. Benda yang permukaannya luas/halus akan mempercepat laju reaksi karena memiliki bidang sentuh yang lebih luas sehingga akan lebih banyak tumbukan yang dapat terjadi.
Sedangkan benda yang permukaannya sempit/kasar akan memperlambat laju reaksi. Hal ini dikarenakan bidang sentuh lebih sempit menyebabkan lebih sedikit tumbukan yang dapat terjadi. Konsentrasi reaktan berbanding lurus dengan laju reaksi. Pengaruh luas permukaan terhadap laju reaksi dapat dilihat pada gambar di bawah ya, Quipperian.
Semakin besar konsentrasi reaktanmaka akan semakin banyak jumlah partikel dalam suatu zat sehingga partikel-partikel yang saling bertumbukan akan semakin banyak dan reaksi berlangsung lebih cepat. Katalisadalah zat yang dapat mempercepat reaksi. Hal ini dikarenakan suatu katalis dapat menurunkan energi aktivasi. Sehingga jumlah tumbukan akan bertambah banyak dan reaksi dapat diselesaikan lebih cepat. Contoh katalis adalah FeCl3pada reaksi penguraian H2O2menjadi H2O dan O2.
Suhu berbanding lurus dengan kelajuan reaksi. Semakin tinggi suhu maka semakin besar juga energi kinetik rata-rata partikel reaktan sehingga akan banyak molekul yang mencapai energi aktivasi (bertumbukan) bertambah dan mempercepat laju reaksi.
Contoh Soal Laju Reaksi

Kalian sudah membaca teori dan konsep tentang persamaan laju reaksi. Sekarang waktunya untuk membahas contoh-contoh soal tentang perhitungan laju reaksi suatu senyawa yuk, Quipperian.
Contoh soal 1
Pada eksperimen dalam reaksi berikut 2NO + Br2 → 2NOBr, didapatkan data sebagai berikut:

Pertanyaan: Tentukan persamaan laju reaksi di atas!
Penyelesaian: Untuk mencari orde reaksi NO, gunakan data eksperimen yang memuat konsentrasi Br2dengan nilai tetap yaitu eksperimen 1 dan 2. Maka diperoleh persamaan:
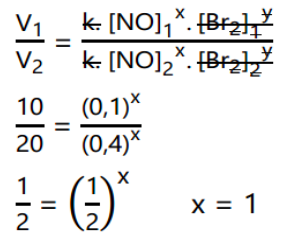
Untuk mencari orde reaksi Br2, kita gunakan eksperimen yang mana saja karena tidak ada data eksperimen yang memuat konsentrasi NO dengan nilai yang sama.
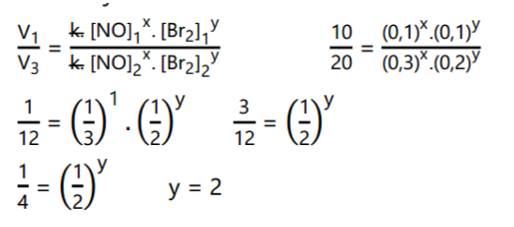
Maka persamaan laju reaksinya adalah:
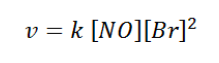
Contoh soal 2
Pada temperatur 270C, gas brom dapat bereaksi dengan nitrogen monoksida menurut persamaan reaksi:
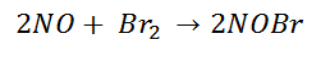
Data hasil eksperimen dari reaksi itu adalah sebagai berikut:
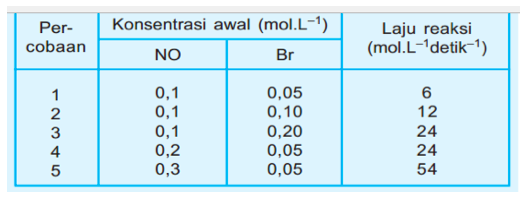
Tentukan:
a. Tingkat reaksi terhadap NO
b. Tingkat reaksi terhadap Br2
c. Tingkat reaksi total
d. Persamaan laju reaksinya
Penyelesaian:
Misalkan persamaan laju reaksi adalah:
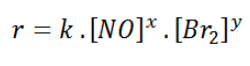
a. Untuk menentukan tingkat reaksi terhadap NO, kita gunakan konsentrasi mol Br2yang sama, yaitu percobaan 1 dan 4. Sehingga diperoleh:
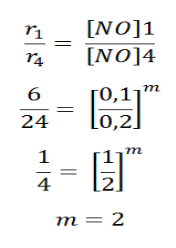
Tingkat reaksi terhadap NO adalah 2
b. Untuk menentukan tingkat reaksi terhadap Br2digunakan konsentrasi mol [NO] yang sama yaitu percobaan 1 dan 2.
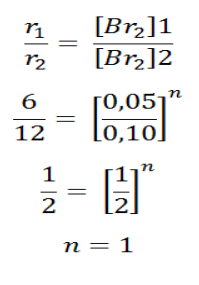
Tingkat reaksi orde Br2 adalah 1
c. Tingkat reaksi orde total adalah m+n = 2+1 = 3
s. Persamaan laju reaksinya adalah sebagai berikut:

Bagaimana Quipperian sudah mulai memahami konsep dan perhitungan tentang kelajuan reaksi? Ternyata gampang juga ya belajar tentang Kimia apabila kita menguasai konsepnya terlebih dahulu. Kalau mau lebih jago lagi, langsung saja yuk gabung sama Quipper Video. Di sana kamu akan bertemu para tutor keren yang bisa memberi kamu pemahaman tentang berbagai materi. Cusss, daftar!
Sumber:
- Priambodo, Erfan, dkk. 2009. Aktif Belajar Kimia. Jakarta:Kemdikbud
- Widhy, Purwaty. Laju Reaksi. Yogyakarta: UNY
- https://materi78.files.wordpress.com
Penulis: William Yohanes
