
Quipperian, apakah kamu sedang atau sudah pernah mempelajari tentang ikatan kovalen dan ikatan ion? Kalau sudah, tentu kamu sudah tidak asing lagi, ya dengan istilah kaidah oktet.
Sebab, istilah kaidah oktet ini cukup sering ditemukan dalam materi ikatan kovalen dan ikatan ion.
Nah, apa itu dimaksud dengan ikatan oktet? Bagaimana cara mengetahui suatu ikatan sudah memenuhi kaidah ini atau belum? Apa saja penyimpangan dalam kaidah oktet? Cari tahu jawabannya lewat pembahasan berikut ini, yuk!
Pengertian Kaidah Oktet
Kaidah oktet adalah aturan yang menyatakan bahwa atom-atom paling stabil ketika kulit terluarnya (kulit valensi) memiliki delapan elektron. Itu artinya, atom-atom yang memiliki elektron kurang dari delapan pada kulit terluarnya akan cenderung membentuk ikatan dengan atom-atom yang lain untuk mencapai kaidah oktet.
Kaidah oktet ini juga disebut dengan konfigurasi stabil gas mulia. Mengapa? Hal ini dikarenakan, atom-atom gas mulia yang terletak pada golongan VIIIA di tabel periodik merupakan atom-atom yang inert (sukar bereaksi).
Atom-atom gas mulia sukar bereaksi karena tergolong atom yang stabil. Menurut G.N Lewis dan W. Kossel, kestabilan atom-atom gas mulia disebabkan oleh elektron valensinya yang berjumlah delapan, kecuali unsur He yang hanya memiliki dua elektron. Hal inilah yang menjadi dasar munculnya kaidah oktet.
Jadi, jika sebuah atom ingin stabil, maka atom tersebut harus memiliki delapan elektron pada kulit terluarnya. Caranya, bisa dengan membentuk ikatan dengan atom-atom yang lain. Ikatan yang terjadi bisa berupa ikatan kovalen, ikatan ion, dan ikatan koordinasi kovalen.
Kaidah Oktet Pada Gas Mulia
Seperti penjelasan sebelumnya, atom-atom gas mulia (golongan VIIIA) merupakan atom yang paling stabil karena memiliki delapan elektron di kulit terluarnya, kecuali atom He. Hal ini menjadi dasar munculnya kaidah oktet.
Berikut adalah konfigurasi elektron pada atom-atom gas mulia.
| Atom | Lambang | Nomor Atom | Konfigurasi Elektron | Elektron Valensi |
|---|---|---|---|---|
| Helium | He | 2 | 2 | 2 |
| Neon | Ne | 10 | 2 8 | 8 |
| Argon | Ar | 18 | 2 8 8 | 8 |
| Kripton | Kr | 36 | 2 8 18 8 | 8 |
| Xenon | Xe | 54 | 2 8 18 18 8 | 8 |
| Radon | Rn | 86 | 2 8 18 32 18 8 | 8 |
Berdasarkan tabel di atas, dapat dilihat bahwa setiap atom-atom gas mulia memiliki delapan elektron pada kulit terluarnya, kecuali atom He karena sudah memiliki konfigurasi elektron penuh sehingga dikenal dengan kaidah duplet.
Ciri-ciri Kaidah Oktet
Dalam ikatan kimia, kamu mungkin tidak hanya menemukan istilah kaidah oktet saja, tapi juga kaidah duplet.
Nah, supaya tidak tertukar dalam membedakan kaidah oktet dan kaidah duplet, kamu perlu mengetahui ciri-ciri kaidah oktet.
- Atom yang memenuhi kaidah oktet memiliki delapan elektron di kulit terluar, sedangkan kaidah duplet, atom memiliki dua elektron di kulit terluarnya.
- Memiliki konfigurasi elektron orbital ns2 np6 pada bagian akhirnya.
- Memiliki minimal dua orbital.
- Oktet dapat memiliki semua jenis orbital seperti s, p, d, f, dan seterusnya.
Tidak semua atom-atom memenuhi kaidah oktet dalam pembentukannya, khususnya atom-atom nonlogam. Ada beberapa atom nonlogam yang tidak memenuhi kaidah oktet ini, antara lain:
1. Reaksi antara atom P (fosfor) dan Cl (klorin)
Reaksi antara atom P dan Cl akan menghasilkan PCl3 dan PCl5. Pada senyawa PCl3, 1 atom P akan mengikat 3 atom Cl.
Sementara pada PCl5, 1 atom P akan mengikat 5 atom Cl. Untuk lebih jelasnya, coba perhatikan gambar struktur Lewis PCl3 dan PCl5 berikut ini.

Setiap atom yang terlibat pada struktur Lewis PCl3 sudah memenuhi kaidah oktet. Lain halnya dengan struktur Lewis PCl5 yang belum memenuhi memenuhi kaidah oktet.
Dapat dilihat bahwa hanya atom Cl saja yang memenuhi kaidah oktet, sedangkan atom P tidak memenuhi kaidah oktet karena memiliki 10 elektron pada kulit terluarnya.
2. Reaksi antara atom B (boron) dan F (fluor)
Senyawa lain yang tidak memenuhi kaidah oktet adalah BF3 yang tersusun dari atom B (boron) dan F (fluor).
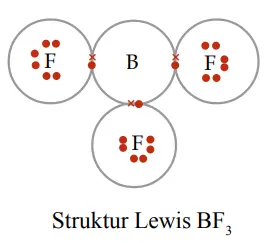
Dari gambar diatas, dapat diketahui bahwa atom B hanya memiliki 3 elektron pada kulit terluarnya sehingga memerlukan 5 elektron untuk memenuhi kaidah oktet. Sementara itu, atom F memiliki 1 elektron saja sehingga hanya memerlukan 7 elektron lagi untuk memenuhi kaidah oktet.
Setiap atom F menerima 1 elektron yang disumbangkan oleh atom B. Namun, atom B hanya menerima 1 elektron saja dari setiap atom F. Itu artinya, atom B masih kekurangan 2 elektron lagi untuk memenuhi kaidah oktet.
Tidak terpenuhinya kaidah oktet pada atom B, membuat senyawa BF3 masuk dalam salah satu senyawa yang tidak memenuhi kaidah oktet.
Cara Mengetahui Kaidah Oktet Sudah Terpenuhi
Ingat, kaidah oktet terpenuhi jika atom memiliki 8 elektron pada kulit terluarnya. Untuk mengetahui apakah kaidah oktet ini sudah terpenuhi atau belum, kamu bisa memeriksanya dengan langkah-langkah berikut ini.
Misalnya, kamu ingin mengetahui apakah senyawa karbon dioksida (CO2) sudah memenuhi kaidah oktet atau belum, maka cara mengetahuinya adalah:
- Buatlah konfigurasi elektron masing-masing atom. Contoh, konfigurasi elektron atom karbon adalah 2 4, sedangkan masing-masing atom oksigen konfigurasi elektronnya adalah 2 6.
- Perhatikan berapa jumlah elektron yang dimiliki pada kulit terluarnya. Pada atom karbon, terdapat 4 elektron di kulit terluarnya, sedangkan atom oksigen memiliki 6 elektron di atom terluarnya.
- Tentukan jumlah elektron yang dibutuhkan untuk memenuhi kaidah oktet. Pada atom karbon, dibutuhkan 4 elektron lagi, sedangkan masing-masing atom oksigen membutuhkan 2 elektron lagi untuk memenuhi kaidah oktet.
- Tambahkan elektron yang dibutuhkan untuk memenuhi kaidah oktet. Penambahan elektron ini berasal dari pasangan elektron bebas dan ikatan yang terhubung ke atom. Artinya, atom karbon memberikan 2 elektron pada atom oksigen, sedangkan masing-masing atom oksigen memberikan 2 elektron pada atom karbon.
- Periksa kembali apakah elektron pada kulit terluar atom karbon dan oksigen sudah berjumlah delapan. Jika sudah, berarti senyawa CO2 sudah memenuhi kaidah oktet.
Pengecualian Kaidah Oktet
Kaidah oktet sangat bermanfaat untuk meramalkan senyawa yang akan dibentuk oleh atom-atom. Namun, ada beberapa pengecualian pada kaidah ini.
Berikut adalah beberapa pengecualian kaidah oktet.
1. Senyawa dengan jumlah elektron valensi ganjil
Beberapa atom ada yang memiliki jumlah elektron valensi (elektron yang terdapat pada kulit terluar) yang ganjil. Contohnya, senyawa NO (nitrogen oksida) dan NO2 (nitrogen dioksida).
Kaidah oktet tidak mungkin terpenuhi pada senyawa dengan jumlah elektron valensi yang ganjil. Sebab, untuk memenuhi kaidah oktet diperlukan pasangan elektron yang lengkap (delapan elektron) yang mana merupakan bilangan genap.
2. Senyawa yang oktetnya tidak sempurna
3. Senyawa yang oktetnya diperluas
Pengecualian atau penyimpangan kaidah oktet juga berlaku pada senyawa yang oktetnya diperluas. Oktet yang diperluas ini terletak pada atom-atom dari periode tiga karena memiliki elektron valensi lebih dari delapan sehingga melebihi kaidah oktet. Contoh, PCl5, SF6, CIF3, IF7, dan SbCl5.
Quipperian, itu dia pembahasan mengenai kaidah oktet dalam ikatan kimia. Semoga dapat meningkatkan pemahaman kamu, ya!
Sumber :
Chang, Raymond. 2004. Kimia Dasar Jilid 1 Edisi Ketiga Konsep-konsep Inti. Jakarta: Penerbit Erlangga
Indayatmi dan Dwi Wuryani. 2021. Analisa Anorganik Kelas 11 SMK. Yogyakarta: AG Publisher
Sutresna, Nana. 2008. Kimia untuk Kelas X Semester 1. Bandung: Grafindo Media Pratama
Rahayu, Iman. 2009. Praktis Belajar Kimia untuk Kelas X. Jakarta: Pusat Perbukuan, Departemen Pendidikan Nasional
Difference Between. https://www.differencebetween.com/difference-between-octet-and-vs-duplet/ Diakses pada 25 Maret 2023
