
Quipperian, apakah kamu pernah menyaksikan panggung yang tiba-tiba mengeluarkan asap? Atau es yang mengapung di atas air? Kedua peristiwa tersebut merupakan penerapan dari gaya antar molekul.
Apa itu gaya antar molekul? Gaya antar molekul adalah gaya tarik menarik yang terjadi di antara molekul-molekul yang saling berdekatan.
Gaya antar molekul sendiri terbagi menjadi tiga jenis. Nah, apa saja itu? Apa saja contoh penerapan gaya antar molekul dalam kehidupan sehari-hari? Mari simak ulasan selengkapnya di bawah ini.
Pengertian Gaya Antar Molekul
Gaya antar molekul adalah gaya tarik-menarik yang terjadi diantara molekul-molekul yang saling berdekatan. Pada suhu tertentu, kekuatan tarikan dari gaya antar molekul ini dapat menentukan wujud zat, apakah gas, cair, atau padat.
Perlu diketahui bahwa gaya antar molekul tidak sama dengan ikatan kimia, seperti ikatan kovalen dan ikatan ion. Maka dari itu, gaya tarik menarik yang dihasilkan oleh gaya ini terbilang lemah dibandingkan ikatan kimia.
Meskipun demikian, konsep gaya antar molekul cukup sering digunakan dalam kehidupan sehari-hari. Gaya antar molekul juga dapat menentukan sifat fisik molekul, seperti titik didih, titik leleh, kerapatan, serta entalpi peleburan dan penguapan.
Jenis-jenis Gaya Antar Molekul
Ada tiga jenis gaya antar molekul, yaitu gaya Van der Waals, gaya London, dan ikatan hidrogen. Yuk, kita bahas satu persatu.
1. Gaya Van der Waals
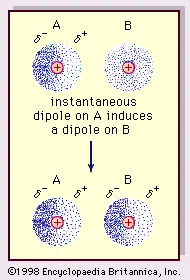
Sumber: van der Waals forces
Gaya Van der Waals atau disebut juga gaya dipol-dipol adalah gaya yang terjadi di antara molekul-molekul yang memiliki sebaran muatan tidak homogen, yaitu molekul-molekul dipol atau molekul polar. Gaya yang berasal dari gaya elektrostatik ini diusulkan pertama kalinya oleh Johannes Van der Waals (1837–1923).
Gaya ini terjadi ketika bagian molekul dipol yang bermuatan positif berinteraksi dengan bagian molekul lain yang bermuatan negatif. Namun, gaya tarik yang terjadi antara molekul-molekul dipol ini cenderung lebih lemah daripada ikatan ion dan ikatan kovalen.
Kekuatan tarikannya juga dapat berkurang dengan cepat bila jarak antara dipol semakin besar.
2. Gaya London
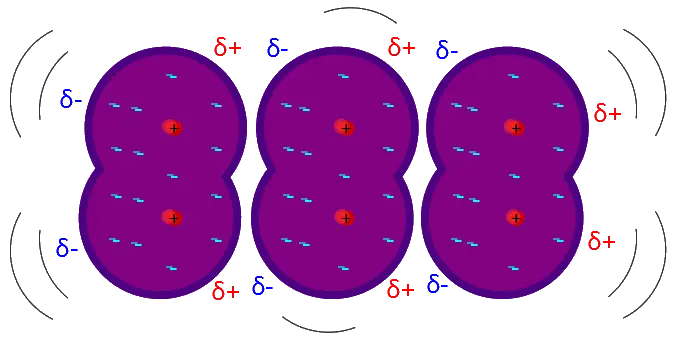
Sumber: Wikipedia
Gaya London adalah gaya yang terjadi pada atom atau molekul, baik polar maupun non polar. Gaya yang dikemukakan oleh Fritz London ini (1930) disebut juga gaya dispersi, yaitu gaya yang timbul karena adanya gesekan sementara (dipol sementara) pada muatan elektron dalam molekul homogen.
Fritz London menjelaskan bahwa pada suatu saat elektron-elektron yang bergerak dan bergeser di dalam molekul akan menimbulkan dipol sesaat (ujung-ujung listrik yang terjadi sesaat). Dipol sesaat ini akan mempengaruhi molekul di sebelahnya sehingga terjadi dipol terinduksi atau terimbas.
Selanjutnya, dipol sesaat dan dipol imbasan ini akan menimbulkan gaya tarik menarik yang menghasilkan gaya London.
Sama seperti gaya Van der Waals, gaya London juga termasuk jenis gaya antar molekul yang relatif lemah.3.
3. Ikatan Hidrogen

Sumber: Hydrogen bonds in water
Ikatan hidrogen adalah salah satu jenis gaya antar molekul yang paling kuat dibandingkan gaya Van der Waals dan gaya London. Namun, masih lebih lemah dibandingkan ikatan kovalen dan ikatan ion.
Ikatan hidrogen terjadi ketika atom H yang bersifat negatif berikatan dengan atom-atom yang bersifat positif, seperti atom F, N, dan O. Contohnya pada senyawa H2O, NH3 dan HF.
Pengaruh Gaya Antar Molekul terhadap Sifat Fisika
Gaya antar molekul yang dihasilkan dapat mempengaruhi sifat fisis senyawa, diantaranya titik didih dan titik leleh, wujud zat, kekentalan, kelarutan, dan bentuk permukaan cairan.
1. Pengaruh ikatan hidrogen terhadap titik didih dan titik leleh
Kekuatan ikatan hidrogen berbanding lurus dengan titik didih dan titik leleh. Semakin kuat ikatan yang terbentuk, maka semakin tinggi titik didih dan titik leleh suatu zat.
2. Pengaruh gaya London terhadap titik didih dan titik leleh
Sama dengan ikatan hidrogen, gaya London juga berbanding lurus dengan titik didih dan titik leleh. Semakin besar gaya London suatu senyawa, maka semakin tinggi pula titik didih dan titik lelehnya.
3. Pengaruh gaya antar molekul terhadap wujud gas nitrogen
Pada suhu rendah, gas nitrogen berwujud cair, sedangkan pada suhu tinggi, gas nitrogen berwujud gas. Perubahan wujud gas nitrogen ini berhubungan dengan gaya antar molekul di mana pada suhu tinggi, gaya antar molekul tidak dapat mempertahankan jarak antar molekul-molekul penyusun nitrogen (N2) agar tetap berdekatan.
Akibatnya, jarak antar molekul penyusun nitrogen pun merenggang dan gas nitrogen berubah wujud menjadi gas.
4. Pengaruh gaya antar molekul terhadap kekentalan cairan
Kemudahan zat untuk mengalir berhubungan dengan gaya antar molekul. Semakin tinggi gaya antar molekulnya, maka semakin sulit suatu zat mengalir karena kekentalannya semakin tinggi.
Kekentalan suatu zat dapat berkurang jika dipanaskan. Sebab, suhu yang panas akan memperbesar jarak antar molekul sehingga gaya antar molekul dan kekentalan pun berkurang.
5. Pengaruh gaya antar molekul terhadap kelarutan
Larutan adalah suatu campuran yang terdiri dari zat terlarut dan pelarut. Larutan ini juga dipengaruhi oleh gaya antar molekul.
Sebagai contoh, air dan etanol. Struktur molekul yang dimiliki oleh etanol memungkinkan untuk membentuk ikatan hidrogen dengan atom O dan atom H dari molekul air.
Ketika air dan etanol dicampurkan, maka akan menghasilkan tiga gaya tarik, yaitu gaya tarik antara zat terlarut (etanol) dan pelarut (air), gaya tarik antar zat terlarut (etanol dan etanol), dan gaya tarik antar pelarut (air dan air). Ketiga gaya tersebut sama kuat sehingga air dan etanol dapat larut sempurna.
6. Pengaruh gaya antar molekul terhadap bentuk permukaan cairan
Pernahkah kamu mengamati bentuk permukaan air di dalam tabung reaksi? Bukankah bentuknya berbeda dengan air yang ditempatkan pada gelas biasa?
Perbedaan bentuk permukaan air dan raksa di dalam tabung reaksi ini juga dipengaruhi oleh gaya antar molekul. Atom H yang terdapat dalam air dan menempel pada tabung reaksi dapat membentuk ikatan hidrogen karena adanya gaya tarik menarik dengan atom O dan SiO2 terkandung dalam tabung reaksi. Hal menyebabkan terbentuknya gaya adhesi.
Selain itu, atom H dari air yang terdapat pada air dan menempel pada tabung reaksi juga dapat membentuk ikatan hidrogen dengan atom H dari air lain yang tidak menempel pada tabung reaksi sehingga terbentuk gaya kohesi.
Permukaan air di tabung reaksi umumnya berbentuk cekung karena gaya adhesi lebih kuat dibandingkan gaya kohesi.
Penerapan Gaya Antar Molekul dalam Kehidupan Sehari-hari
Konsep gaya antar molekul ini cukup sering diterapkan dalam kehidupan sehari-hari. Berikut beberapa contoh penerapannya.
1. Menjaga keberadaan molekul DNA
Gaya antar molekul memiliki peranan penting dalam biologi. Salah satunya adalah menjaga keberadaan molekul DNA.
DNA atau asam deoksiribo nukleat atau DNA adalah senyawa kimia yang menyimpan semua informasi genetik makhluk hidup. Jenis gaya antar molekul yang bertanggung jawab atas keberadaan molekul DNA ini adalah ikatan hidrogen.
2. Pembentukan gelembung pada sabun
Gelembung sabun terdiri dari molekul sabun dan molekul air. Air adalah molekul polar, sedangkan gelembung sabun memiliki ujung polar dan non-polar.
Ujung kutub kedua molekul dapat menghasilkan gaya tarik menarik satu sama lain sehingga membantu pembentukan gaya antar molekul. Interaksi antarmolekul ini berperan penting dalam pembentukan gelembung pada sabun.
3. Asap di Panggung
Kamu tentu pernah melihat panggung yang mengeluarkan asap, tapi bukan karena ada kebakaran, kan? Peristiwa ini merupakan salah satu bentuk penerapan gaya antar molekul.
Asap yang dikeluarkan berasal dari alat yang disebut smoke machine atau fog machine. Alat ini bisa mengeluarkan asap karena menggunakan es kering yang merupakan padatan karbon dioksida.
Es tersebut tidak mencair, melainkan berubah wujud dari zat padat menjadi gas. Perubahan wujud ini dipengaruhi oleh gaya antar molekul di mana ketika suhu dinaikkan, gaya antar molekul tidak dapat mempertahankan jarak antar molekul-molekul penyusun karbon dioksida agar tetap berdekatan sehingga terjadi perubahan wujud dari zat padat menjadi gas.
Itu dia pembahasan mengenai gaya antar molekul. Semoga dapat menambah wawasan kamu, ya.
Sumber :
Sunarya, Yayan dan Agus Setiabudi. 2007. Mudah dan Aktif Belajar Kimia. Bandung: PT Setia Purna Inves
Suyatno, dkk. 2007. Kimia untuk SMA/MA Kelas XI. Jakarta: Grasindo
Muchtaridi dan Sandri Justiana. 2007. Kimia 2 SMA Kelas XI. Palembang: Quandra
Premono, Shidiq, Anis Wardani, dan Nur Hidayat. 2009. Kimia : SMA/ MA Kelas XI. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional
Harnanto, Ari dan Ruminten. 2009. Kimia 2 : Untuk SMA/MA Kelas XI. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional
Sulastri, dkk. 2017. Buku Ajar- Kimia Dasar I. Banda Aceh: Syiah Kuala University Press
Khan Academy. https://www.khanacademy.org/science/class-11-chemistry-india/xfbb6cb8fc2bd00c8:in-in-states-of-matter/xfbb6cb8fc2bd00c8:in-in-intermolecular-forces/a/intramolecular-and-intermolecular-forces Diakses pada 22 Maret 2023
Studios Guy. https://studiousguy.com/intermolecular-forces-types-examples/ Diakses pada 22 Maret 2023
